29-01-2018
Cette bactérie provoque 600 000 cancers chaque année et personne n'en parle
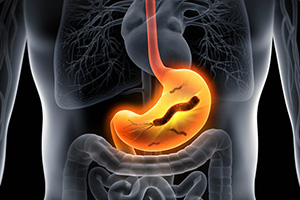 Chaque année, près de 750 000 personnes meurent d’un cancer de l’estomac, l’un des cinq cancers les plus meurtriers. La raison principale ? Une bactérie pathogène qui colonise l’estomac d’une personne sur deux dans le monde et qui était encore totalement inconnue il y a 40 ans. A-t-elle envahi les couches profondes de votre estomac ? Faites-vous partie des prochaines victimes ?
Chaque année, près de 750 000 personnes meurent d’un cancer de l’estomac, l’un des cinq cancers les plus meurtriers. La raison principale ? Une bactérie pathogène qui colonise l’estomac d’une personne sur deux dans le monde et qui était encore totalement inconnue il y a 40 ans. A-t-elle envahi les couches profondes de votre estomac ? Faites-vous partie des prochaines victimes ?
Jusqu’en 1982, il était inconcevable qu’un organisme vivant puisse proliférer dans un milieu aussi hostile que notre estomac. Et pourtant, deux chercheurs vont découvrir l’existence d’une bactérie inconnue en étudiant la paroi de l’estomac de personnes atteintes d’ulcères. Elle est rapidement suspectée de provoquer des troubles gastriques divers, notamment le cancer de l’estomac, et dès 1994, sa culpabilité est avérée : l’Agence Internationale de Recherche sur le Cancer classe la bactérie Helicobacter Pylori comme carcinogène de classe I, c’est-à-dire entraînant un risque de cancer certain chez l’homme. Aujourd’hui, le nombre de ses victimes apparaît vertigineux : entre 500 000 et 700 000 personnes succombent chaque année des suites d’une lente colonisation de leur estomac. La situation est d’autant plus alarmante qu’une personne sur deux dans le monde serait infectée !
Comment Helicobacter Pylori provoque-t-elle le cancer ?
Comment cette bactérie peut-elle survivre à l’acidité exceptionnelle de l’estomac ? Comment expliquer qu’elle puisse rester discrète pendant des années avant de déclencher subitement un cancer ? Grâce aux toutes dernières études parues en décembre 2017, les chercheurs commencent à avoir des réponses précises à ces deux questions.
Helicobacter Pylori est une bactérie exclusivement adaptée à l’estomac humain. Avec ses filaments mobiles, elle est capable de se déplacer dans le suc gastrique et traverser sans peine le mucus qui recouvre la paroi de l’estomac. Elle y survit grâce à sa production d’uréase, une protéine qui permet de neutraliser l’acidité du milieu par la transformation de l’urée en ammoniac qu’elle induit1. Une fois dans l’estomac, la bactérie sécrète une enzyme (la HtrA) capable de couper les liaisons qui attachent les cellules de la muqueuse gastrique entre elles. Or, ces liaisons garantissent l’imperméabilité de la couche protectrice de l’estomac. Toute rupture permet donc à Helicobacter Pylori de franchir la barrière et de s’immiscer dans les couches les plus profondes, normalement inaccessibles aux pathogènes, afin d’y infliger des dommages dans la clandestinité la plus totale.
Mais que fait le système immunitaire pendant ce temps-là ?
La présence d’Helicobacter pylori dans les couches profondes de l’estomac ne manque pas d’alerter la patrouille et de provoquer une inflammation chronique, mais la bactérie a plus d’un tour dans son sac. En s’accolant aux cellules hôtes des couches profondes, elle leur injecte une toxine, la protéine Cag A, capable de reprogrammer leur fonctionnement pour empêcher le système immunitaire de les reconnaître ou de les éliminer2. Cette étape est cruciale : elle permet aux bactéries de proliférer et de survivre à long terme dans l’organisme, au nez et à la barbe des gardiennes de l’immunité. Mais c’est elle aussi qui va transformer les cellules, à long terme, en cellules tumorales : la protéine Cag A commande en réalité une multitude de signaux secondaires, dont certains sont associés au cancer3-5 (l’expression de la bêta-caténine et la transition épithélio-mésenchymateuse notamment). Cela ne veut pas dire que toutes les personnes infectées développeront un cancer, mais que le risque chez eux est largement augmenté, tout comme chez les fumeurs, les consommateurs excessifs de viande rouge et de sel, ou les personnes régulièrement exposées aux nitrites. Le gros problème, c’est que le cancer de l’estomac est souvent diagnostiqué à un stade trop avancé pour être traité efficacement, et que le meilleur moyen d’en guérir c’est encore de s’assurer qu’un parasite ne vit pas secrètement dans ses sous-sols gastriques.
Y a-t-il un moyen de savoir si vous êtes infecté(e) ?
Contrairement à ce que laissent présager les statistiques, il n’est pas si facile de transmettre la bactérie à une autre personne. En fait, la contamination se fait dans la grande majorité des cas durant l’enfance. Elle peut se transmettre par la salive ou par le partage des couverts, si la personne infectée a eu des régurgitations ou des vomissements au préalable. C’est pour cette raison que la transmission de la bactérie se fait surtout en bas âge, à l’école ou en famille : l’infection de l’adulte est assez peu fréquente et une fois traitée, la réinfection est même rarissime6.
Il existe différents tests permettant d’attester la présence de la bactérie dans votre estomac. Votre médecin peut rechercher dans votre sang les anticorps dirigés contre la bactérie, repérer des traces de celles-ci dans vos selles ou détecter sa présence par le biais d’un test respiratoire, qui consiste à souffler dans un tube après avoir bu un révélateur.
Mais, il est également possible de le deviner. Puisque la couche protectrice de l’estomac est régulièrement tailladée par les bactéries, et que l’acidité y est souvent perturbée, les personnes infectées ont parfois des indices de la présence du pathogène. Les sucs gastriques peuvent attaquer les cellules plus profondes, insuffisamment protégées par la muqueuse, et provoquer des maux d’estomac récurrents, des ulcères et une inflammation chronique se traduisant par un inconfort gastrique ou une pesanteur digestive (qui survient généralement quelques heures après le repas). Les toxines d’Helicobacter pylori taquinent également le système immunitaire, lequel réagit par une prolifération lymphocytaire (sans effet sur les bactéries) pouvant à terme aboutir à un lymphome. Mais la plupart du temps, les indices ne sont pas suffisamment éloquents et c’est ce qui rend la bactérie si dangereuse…
Comment se débarrasser d’Helicobacter pylori au plus vite ?
Plus vite vous aurez chassé ce parasite de votre estomac, plus vite vous stopperez l’évolution des lésions déjà existantes vers un cancer de l’estomac. Si vous souffrez de douleurs et d’inconforts gastriques depuis des années, vous risquez également de voir la différence.
Le traitement conventionnel consiste à associer deux antibiotiques et un médicament destiné à diminuer l’acidité de l’estomac, pendant près de 2 semaines7. Mais, depuis une vingtaine d’années, les chercheurs ont remarqué que les souches d’Helicobacter pylori devenaient de plus en plus résistantes aux antibiotiques. La communauté scientifique s’est donc plié en quatre pour tenter d’identifier des alternatives à cette thérapie pas toujours exempte d’effets secondaires.
Une piste se détache actuellement et constitue un complément ou une alternative crédible à la thérapie actuelle : la supplémentation en Lactobacillus reuteri, un probiotique inhibiteur d’Helicobacter pylori. Des chercheurs ont démontré in vitro et in vivo sa capacité à interférer avec l’adhérence du pathogène et à produire des molécules antimicrobiennes qui entravent son développement8-9. Concrètement, le probiotique réduit la quantité d’Helicobacter pylori en formant avec lui des co-agrégats évacués hors de l’estomac, puis expulsés de l’organisme par le biais du conduit intestinal. Il s’agit donc d’une alternative qui n’interfère pas avec la flore intestinale et qui ne permet pas à la bactérie de devenir résistante aux traitements. Des études avaient par ailleurs mis en évidence la propension de ce probiotique à renforcer la barrière épithéliale (laquelle est détériorée par Helicobacter pylori) et à accélérer sa réparation10.
La prise d’un supplément de Lactobacillus reuteri est donc vivement conseillée aux personnes suspectant la présence d’Helicobacter pylori dans leur estomac. Elle gagnera à être accompagnée d’une augmentation de l’apport en antioxydants issus des fruits et légumes (vitamine C et vitamine E notamment) 11 et pourra renforcer un traitement antibiotique chez les personnes les plus à risque du cancer de l’estomac (cumulant plusieurs facteurs de risque ou dont les membres de la famille ont développé un cancer de l’estomac par le passé). D’ici quelques années, d’autres traitements visant plus spécifiquement la bactérie verront probablement le jour : la toxine Cag A injectée par la bactérie et l’enzyme Htra qui découpe les points de jonction entre les cellules sont les deux cibles prioritaires.
Références
1. Frédéric Fischer, Marie Robbe-Saule, Evelyne Turlin, Francesco Mancuso, Valérie Michel, Pierre Richaud, Frédéric J. Veyrier, Hilde De Reuse, Daniel Vinella. Characterization in Helicobacter pylori of a Nickel Transporter Essential for Colonization That Was Acquired during Evolution by Gastric Helicobacter Species. PLOS Pathogens, 2016; 12 (12): e1006018 DOI: 10.1371/journal.ppat.1006018
2. Nicole Tegtmeyer, Silja Wessler, Vittorio Necchi, Manfred Rohde, Aileen Harrer, Tilman T. Rau, Carmen Isabell Asche, Manja Boehm, Holger Loessner, Ceu Figueiredo, Michael Naumann, Ralf Palmisano, Enrico Solcia, Vittorio Ricci, Steffen Backert. Helicobacter pylori Employs a Unique Basolateral Type IV Secretion Mechanism for CagA Delivery. Cell Host & Microbe, 2017; 22 (4): 552 DOI: 10.1016/j.chom.2017.09.005
3. Franco, A.T., Israel, D.A., Washington, M.K., Krishna, U., Fox, J.G., Rogers, A.B., Neish, A.S., Collier-Hyams, L., Perez-Perez, G.I., Hatakeyama, M., et al. (2005). Activation of beta-catenin by carcinogenic Helicobacter pylori. Proc. Natl. Acad. Sci. USA 102, 10646–10651.
4. Murata-Kamiya, N., Kurashima, Y., Teishikata, Y., Saito, Y., Higashi, H., Aburatani, H., Akiyama, T., Peek, R.M., Jr., Azuma, T., et al. (2007). Helicobacter pylori CagA interacts with E-cadherin and deregulates the beta-catenin signal that promotes intestinal transdifferentiation in gastric epithelial cells. Oncogene 26, 4617–4626.
5. Lee, D.G., Kim, H.S., Lee, Y.S., Kim, S., Cha, S.Y., Ota, I., Kim, N.H., Cha, Y.H., Yang, D.H., Lee, Y., et al. (2014). Helicobacter pylori CagA promotes Snailmediated epithelial-mesenchymal transition by reducing GSK-3 activity. Nat. Commun. 5, 4423.
6. Brown LM. Helicobacter pylori : epidemiology and routes of transmission. Epidemiologic reviews 2000;22(2):283-97
7. Courillon-Mallet A. Résistance de Helicobacter pylori : qui traiter et comment ? Presse Med 2006 ;35 :657-62.
8. Holz C, Busjahn A, Mehling H, Arya S, Boettner M, Habibi H, Lang C. Significant Reduction in Helicobacter pylori Load in Humans with Non-viable Lactobacillus reuteri DSM17648: A Pilot Study. Probiotics Antimicrob Proteins. 2015 Jun;7(2):91-100. doi: 10.1007/s12602-014-9181-3.
9. Mehling H, Busjahn A. Non-viable Lactobacillus reuteri DSMZ 17648 (Pylopass™) as a new approach to Helicobacter pylori control in humans. Nutrients. 2013 Aug 2;5(8):3062-73. doi: 10.3390/nu5083062.
10. Lu L, Walker WA. Pathologic and physiologic interactions of bacteria with the gastrointestinal epithelium. Am J Clin Nutr 2001;73;1124S-1130S.
11. Malfertheiner P et al. Current concepts in the management of Helicobacter pylori infection : the Maastricht III consensus report. Gut 2007;56:772-81
Commander les nutriments évoqués dans cet article

Le probiotique Lactobacillus reuteri est abondamment étudié dans le domaine de la santé cardiovasculaire
www.supersmart.comA découvrir aussi
10-10-2016
En Inde, le curcuma est utilisé pour traiter toute une variété d'indispositions incluant des problèmes gastro-intestinaux, des troubles inflammatoires, des maux de tête, des infections...
Lire plus22-02-2017
A l’époque de Louis XIV, grand constipé devant l’éternel, les médecins qui le suivaient avaient pris pour habitude de lui demander « Comment allez-vous ?...
Lire plus31-07-2017
Les fringales apparaissent aussi bien chez les personnes désirant perdre du poids que chez celles qui ont un poids stable. Afin de trouver des solutions...
Lire plus© 1997-2026 Fondation pour le Libre Choix
Tous droits de reproduction réservés
Tous droits de reproduction réservés
Gratuit
Merci de votre visite, avant de partir
inscrivez-vous auClub SuperSmart
Et bénéficiez
d'avantages exclusifs:
d'avantages exclusifs:
- Gratuit : la publication hebdomadaire scientifique "Nutranews"
- Des promotions exclusives aux membres du club