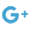Améliorer le fonctionnement des mitochondries
Par Bruno Lacroix *
Les effets du surmenage sur l'homme sont dévastateurs, sans parler des conséquences liées à un environnement hostile (« malbouffe », pollution
). Ce sont ses cellules qui en subissent les conséquences, tout particulièrement les mitochondries, véritables chaudières productrices d'énergie, qui finissent par capituler et s'oxyder.
Pour l'homme moderne, manger comme les centenaires d'Okinawa ne suffit pas : c'est avant tout son style de vie qu'il doit changer. Pas facile pour la majorité des hommes, mais pas de panique, d'autres alternatives existent, comme celle de prendre soin de ses mitochondries.
Les mitochondries vivent dans chacune de nos cellules et accomplissent leurs tâches quotidiennes : les cellules musculaires se contractent, celles du foie détoxiquent, celles du cerveau donnent l'impulsion chimique que l'on nomme la pensée ; pour ce faire, elles ont besoin d'énergie. Lorsque l'on est fatigué, surmené ou au bout du rouleau, c'est tout d'abord une perte d'énergie cellulaire. Cet état indique que le métabolisme fonctionne mal, notamment le système énergétique, c'est-à-dire le processus de conversion des aliments en énergie. Si le métabolisme fonctionne mal, différents problèmes, allant de la sarcopénie au syndrome de fatigue chronique, de la fibromyalgie jusqu'aux maladies neurodégénératives, telle la maladie d'Alzheimer, peuvent apparaître.
Afin de ralentir le processus du vieillissement et d'avoir « le punch », la première des choses est d'adopter une stratégie d'amélioration mitochondriale.
* Diplômé universitaire Nutrition et Micronutrution
1. Nos mitochondries : véritables chaudières d'énergie L'individu ne compte pas moins de dix mille milliards de mitochondries responsables, chaque jour, de la production d'environ 40 kg d'ATP (acide adénosine triphosphorique), la monnaie énergétique universelle qu'utilise la cellule pour effectuer tous les travaux nécessaires à son maintien en vie mais aussi à notre énergie.
L'individu ne compte pas moins de dix mille milliards de mitochondries responsables, chaque jour, de la production d'environ 40 kg d'ATP (acide adénosine triphosphorique), la monnaie énergétique universelle qu'utilise la cellule pour effectuer tous les travaux nécessaires à son maintien en vie mais aussi à notre énergie.
Nos mitochondries sont les véritables centrales énergétiques de nos cellules : elles produisent 90 % de l'énergie qui nous est nécessaire pour vivre.
Hélas, cette production d'ATP diminue parallèlement à l'augmentation des radicaux libres. Le professeur Bruce Ames, chercheur à l'université de Californie à Berkeley (spécialiste du stress oxydatif et des mitochondries), a amassé un nombre d'études convaincantes prouvant le lien entre l'oxydation des mitochondries et le processus du vieillissement.
Il a découvert qu'avec l'âge, l'accumulation des dommages oxydatifs sur les enzymes humaines était responsable d'une diminution de leur efficacité. Les mitochondries, devenant plus pauvrement équipées en antioxydants ou en systèmes de réparation de l'ADN, sont susceptibles de subir un déclin similaire avec l'âge.
Ces radicaux finissent par endommager durablement les mitochondries elles-mêmes en altérant leur code génétique. Ainsi, au fil des années, les mitochondries produisent de moins en moins d'énergie et de plus en plus de radicaux qui vont percuter tous les composants de la cellule. C'est la raison principale pour laquelle à 80 ans on se sent plus fatigué et plus essoufflé qu'à 20 ans, et qu'on est aussi moins musclé et moins alerte intellectuellement.
2. Diminution de la production de l'ATP mitochondrial
Bien avant de se dégénérer, les mitochondries voient leur fonction diminuer. Environ 35 à 50 % des personnes de plus de 35 ans montrent déjà un affaiblissement de la production d'ATP dans les mitochondries.
Aujourd'hui, les causes sont loin d'être complètement élucidées, mais parmi elles on trouve l'hypoxie, l'ischémie, la diminution du métabolisme des graisses, l'hypothyroïdie, des anomalies du fonctionnement des UCP, une déficience en cortisol, une méthylation diminuée, un excès d'insuline, etc. L'environnement a également un impact majeur sur nos mitochondries. En effet, l'air, la pollution (plomb, mercure, produits organochlorés
), les eaux traitées (dénaturées par le chlore et le fluor), la nourriture industrielle (pesticides, herbicides, antibiotiques, hormone de croissance, OGM, radiation au cobalt 60, additifs), la pollution électromagnétique (ondes, champs magnétiques, radiations diverses), le stress (vulnérabilité aux virus, bactéries, toxines) - la liste n'est pas exhaustive - sont tous destructeurs des mitochondries. La production d'ATP par la phosphorylation oxydative de la mitochondrie génère naturellement des radicaux libres, mais lorsque l'environnement s'y ajoute, la balance se déséquilibre, la surproduction des radicaux libres est encore plus agressive sur nos mitochondries et fait diminuer notre espérance de vie.
|
Maladies dans lesquelles la dysfonction des mitochondries est impliquée
|
|
| Les diabètes (Wallace, 2005 ; Fosslien, 2001 ; West, 2000). La maladie d'Huntington (Stavrovskaya et Kristal, 2005). Le cancer (Wallace, 2005), incluant l'hépatite C et le virus associé à l'hépatocarcinogenèse (Koite, 2005). La maladie d'Alzheimer (Stavrovskaya et Kristal, 2005). La maladie de Parkinson (Stavrovskaya et Kristal, 2005). Le désordre bipolaire (Stork et Renshaw, 2005 ; Fattal et al., 2006). Le vieillissement et la sénilité (Wallace, 2005 ; Savitha et al., 2005 ; Schulachev et Lougo, 2005 ; Corral-Debrinski et al., 1992 ; Ames et al., 1993). |
La schizophrénie (Fattal et al., 2006). Les troubles de l'anxiété (Eimat et al., 2005). La stéatohépatite non alcoolique (Lieber et al., 2004). Les maladies cardio-vasculaires (Fosslien, 2001), incluant l'athérosclérose (Puddu et al. 2005). La sarcopénie (Bua et al., 2002). L'intolérance à l'exercice (Conley et al., 2000). La fatigue, incluant le syndrome de fatigue chronique (Fulle e t al., 2000 ; Buist, 1989), la fibromyalgie (Park et al., 2000 ; Yunus et al., 1988) et la souffrance myofaciale (Yunus et al., 1988). |
Les radicaux libres oxygénés ont des effets dévastateurs sur nos mitochondries. L'une des théories expliquant le syndrome de fatigue chronique si répandu aujourd'hui est que l'augmentation de l'ion peroxynitrite, métabolite du NO, dans le cerveau, est néfaste pour les mitochondries.
Le peroxynitrite inactive plusieurs enzymes mitochondriales importantes, menant à un dysfonctionnement métabolique avec pour conséquences de la fatigue et une perte d'énergie.
La bonne nouvelle est que le docteur Bruce Ames a argumenté que l'oxydation qui accélérait le vieillissement et les pathologies modernes pouvait être compensée (au moins partiellement) par une supplémentation avec des taux plus élevés de micronutriments régénérateurs des mitochondries.
La diminution de la production d'ATP mitochondrial est au cœur de toute maladie mais aussi du vieillissement
1. Toute maladie dégénérative ainsi que le vieillissement sont précédés par une diminution de la production d'ATP dans les mitochondries qui se produit bien avant la dégénérescence mitochondriale.
2. Cette diminution de la production d'ATP dans les mitochondries est la conséquence de la réduction du métabolisme des acides gras qui conduit à l'affaiblissement de l'efficacité des mitochondries par une combinaison d'hypoxie, d'ischémie, d'un dysfonctionnement des UCP, de toxicité ainsi que de déficiences nutritionnelles et hormonales.
3. Cette diminution de la production d'ATP des mitochondries conduit à terme à une dégénérescence mitochondriale et provoque ainsi des maladies dégénératives et un vieillissement prématuré.
4. Ce processus impliqué dans la dégénérescence mitochondriale, le vieillissement prématuré et les pathologies dégénératives peut être ralenti et même supprimé en augmentant la production d'ATP par les mitochondries.
3. Stratégie d'augmentation de la production de l'ATP mitochondrial En règle générale, il est d'abord important d'adopter une stratégie globale afin de se donner toutes les chances de retrouver plus d'énergie
En règle générale, il est d'abord important d'adopter une stratégie globale afin de se donner toutes les chances de retrouver plus d'énergie
1. Doser son énergie. Ne pas utiliser l'énergie plus vite que nos mitochondries peuvent la produire. S'assurer que nos mitochondries sont bien nourries pour éviter que l'endommagement cellulaire ne s'accélère avec toutes les conséquences que cela peut avoir : stress oxydatif accentué.
2. Nourrir la mitochondrie. Apporter les matières premières nécessaires à la mitochondrie, soit pour guérir, soit pour un rendement plus efficace, comme D-ribose, coenzyme Q10, acétyl-L-carnitine, magnésium et vitamines B (B1, B2).
3. S'attaquer aux causes sous-jacentes. Les raisons de l'endommagement des mitochondries sont multifactorielles, mais en appliquant ces principes par ordre d'importance, on restaure leur fonctionnement :
- éliminer les produits transformés, la « malbouffe », le sucre et les calories vides qui sont des « killers » mitochondriaux. Donc manger moins et mieux (régimes crétois, méditerranéen) ;
améliorer le statut antioxydant (le processus de production d'énergie produit des radicaux libres qui, s'ils ne sont pas jugulés, créent d'autres dommages sur les mitochondries) ;
bien dormir permet de réparer les mitochondries ;
l'identification et l'élimination des substances qui inhibent la fonction mitochondriale :
- - métaux lourds, pesticides, médicaments, poisons sociaux (tabac, alcool),
- alimentation trop riche en hydrates de carbone,
- allergies alimentaires, produits chimiques, cosmétiques, micro-organismes.
4. S'attaquer aux dommages secondaires causés par l'épuisement mitochondrial, comme l'immunosuppression résultant des allergies, une mauvaise fonction digestive, une déficience hormonale, une détoxication du foie trop lente et l'hyperventilation.
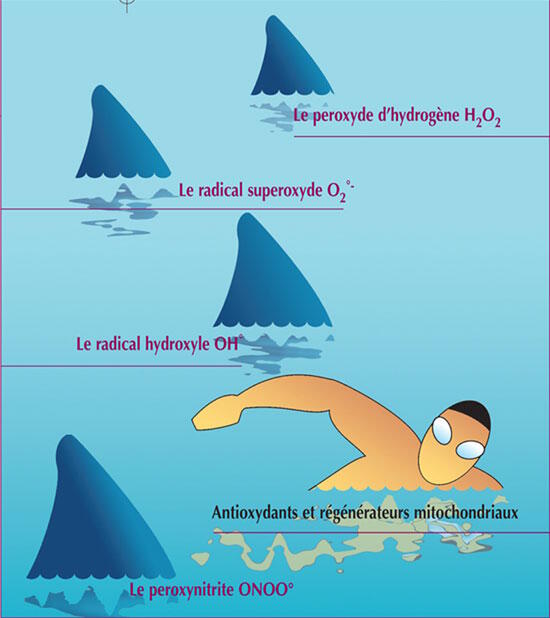
¤ Il existe 5 ensembles de protéines et de coenzymes impliqués dans les oxydations phosphorylantes de la chaîne respiratoire.
¤ Les 4 premiers complexes (I, II, III et IV) interviennent dans le transport des électrons et le cinquième (V) intervient dans la synthèse d'ATP.
¤ Ces complexes diffusent de façon indépendante au sein de la membrane interne et connectés par un transporteur liposoluble mobile, le coenzyme Q, (CoQ) et le cytochrome C fixé à la membrane.
Complexe I : NADH-ubiquinone réductase ;
Complexe II : succinate-ubiquinone réductase ;
Complexe III : ubiquinone-cytochrome C réductase ;
Complexe IV : cytochrome oxydase ;
Complexe V : ATP synthétase.
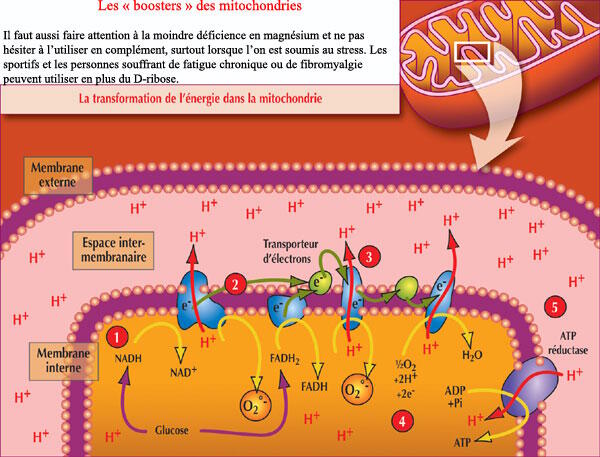
La coenzyme Q10
La coenzyme Q10 est le cofacteur mitochondrial majeur. C'est elle qui transporte les électrons provenant des complexes I, II et III dans la membrane interne des mitochondries. En plus d'augmenter la biosynthèse de l'ATP (molécule de l'énergie universelle) et d'agir comme un puissant antiradicalaire, la CoQ10 réduit également le niveau d'acide lactique, augmente la force musculaire tout en diminuant la fatigabilité musculaire1.
L'idébénone
L'idébénone est un analogue de la CoQ10, avec des propriétés similaires mais offrant cependant une meilleure protection des mitochondries, notamment contre les radicaux libres oxygénés, qui causent le plus de dommages à l'ADN mitochondrial. L'idébénone est également plus efficace que la CoQ10 dans la chaîne de transport d'électrons2.
L'acétyl-L-carnitine
Des changements des mitochondries surviennent avec l'âge, notamment l'altération de la membrane mitochondriale3, avec une réduction des niveaux de cardiolipine (un phospholipide qui sert de cofacteur de transport des protéines mitochondriales), de coenzyme Q10 et de la concentration en carnitine (un facteur important dans la bêta-oxydation des acides gras)4.
Le docteur Hagen Tory, de l'université de Californie, a suggéré que des suppléments alimentaires pourraient inverser certains de ces changements mitochondriaux liés à l'âge. Il a démontré que l'acétyl-L-carnitine (ALC) restaure le potentiel des membranes des mitochondries, le niveau de cardiolipine des souris âgées mais aussi celle des jeunes, qu'il facilite le transport des acides gras dans les mitochondries et augmente la respiration cellulaire globale. Les chercheurs ont également noté que l'ALC améliore les performances cognitives, augmente la production des neurotransmetteurs et restaure les niveaux de certains récepteurs hormonaux. Ils ont conclu que la baisse de l'ALC liée à l'âge est responsable d'un dysfonctionnement cellulaire, principalement parce qu'il maintient la fonction mitochondriale5.
N-acétyl-cystéine
Le dysfonctionnement mitochondrial est principalement dû à des changements qui se produisent dans la chaîne respiratoire, plus précisément dans la phosphorylation oxydative. Une équipe de chercheurs du département de biophysique de l'université de Kalyani, en Inde, a étudié les effets de la N-acétyl cystéine (NAC) sur les principaux éléments de la chaîne respiratoire6. Elle a administré de la NAC à des rats matures. Après 20 semaines de traitement, les chercheurs ont constaté que les activités des complexes I, IV et V étaient significativement plus élevées chez les rats traités par rapport aux contrôles. La NAC a également contribué à maintenir le glutathion des mitochondries.
(R)-acide alpha-lipoïque
Le docteur David Horrobin, du groupe du Trinity College de Dublin, en Irlande, a estimé qu'un régime alimentaire complété par de l'acide alpha-lipoïque inversait un certain nombre de modifications liées à l'âge dans le cerveau des rats7. Ces modifications comprenaient : une augmentation de l'activité des enzymes antioxydantes, la superoxyde dismutase (SOD), la catalase, le glutathion peroxydase (GSH px) et une diminution de la production de radicaux libres.
Le docteur Hagen Tory, de l'université de Californie, a constaté que la consommation d'oxygène des mitochondries de rats âgés traités par le (R)-acide alpha-lipoïque a été entièrement restaurée de façon similaire à celle de jeunes rats.
Les chercheurs ont également constaté que le (R)-acide alpha-lipoïque, tout comme la NAC, a augmenté le potentiel de la membrane mitochondriale des rats âgés de près de 50 %, par rapport à des rats jeunes.
La supplémentation en acide alpha-lipoïque a également augmenté le glutathion et la vitamine C des mitochondries chez des bovins âgés, de façon beaucoup plus importante que chez de jeunes animaux8.
Hagen et ses collègues ont conclu que la supplémentation en acide alpha-lipoïque améliore le dysfonctionnement des mitochondries lié à l'âge et à la baisse de l'activité métabolique, tout en augmentant la synthèse de l'ATP et l'absorption du glucose. Les chercheurs ont également conclu que la supplémentation en acide alpha-lipoïque peut être un moyen sûr et efficace pour améliorer l'activité métabolique générale et augmenter le statut antioxydant. Un effet non négligeable est sa contribution à la détoxication de notre organisme par un effet chélateur sur les métaux toxiques, néfastes pour les mitochondries.
Oméga-3
Les scientifiques de l'Institut national sur le troisième âge (INTA) ont révélé que les acides gras de la famille des oméga-3 provenant d'huile de poisson sont cardio-protecteurs, dans la mesure où ils minimisent l'augmentation de la teneur en calcium mitochondrial, tout en évitant la diminution de la cardiolipine et de la phosphatidylcholine9. Le docteur Salvatore Pepe de l'Alfred Hospital Cardiac Surgical Research Unit, à Melbourne, en Australie, a signalé des résultats semblables. Le docteur Pepe a démontré qu'une alimentation riche en oméga-3 augmente directement la concentration de cardiolipine des membranes mitochondriales10.
Niacinamide (vitamine B3)
Le docteur Christopher Driver et Angela Georgiou de l'Institut national de recherche sur le vieillissement en Australie ont testé l'efficacité de la niacinamide en redynamisant le système de bioénergie des mouches. Après avoir administré la niacinamide (250 mcg/ml d'eau) à des mouches, ils ont déterminé qu'elle atténuait les changements liés à l'âge et prolongeait leur durée de vie de 15 %11.
Thiamine (vitamine B1)
De fortes doses de thiamine (vitamine B1) ont été utilisées pour stimuler le NADH, qui augmente la phosphorylation oxydative du complexe I. Des doses de 300 mg par jour chez les patients ayant une ophtalmoplégie externe chronique ont abouti à la normalisation des taux sanguins de lactate et de pyruvate12.
Riboflavine (vitamine B2)
La riboflavine (vitamine B2) fonctionne comme un cofacteur des complexes I et II. À la dose de 100 mg par jour, on améliore la capacité d'effort chez un patient atteint d'une myopathie mitochondriale due à un dysfonctionnement du complexe I13.
Exercice
Les sujets âgés ont tendance à utiliser plus de glucose et moins de graisses au cours de l'exercice que les sujets jeunes. Toutefois, l'exercice en endurance augmente la capacité respiratoire, diminue la production de glucose et augmente l'oxydation des graisses, ce qui permet de corriger ou compenser dans une certaine mesure les altérations liées à l'âge14.
Un argument mis en avant par certains scientifiques, comme excuse à leur style de vie sédentaire, est le fait que l'exercice augmente la production de radicaux libres. Toutefois, les scientifiques de l'institut Guang-Zhou d'éducation physique à Canton, en Chine, ont montré que l'exercice en endurance augmente effectivement la production de la manganèse-superoxyde dismutase mitochondriale (MnSOD) et du glutathion peroxydase (GSH px), ce qui donne une augmentation générale de l'activité antioxydante et une diminution de la peroxydation des lipides15.
Ginkgo biloba
L'extrait de Ginkgo biloba, quant à lui, permet de protéger l'ADN mitochondrial (MtDNA) contre les dommages oxydatifs16. Les chercheurs ont découvert que l'extrait de Ginkgo biloba empêche également les changements morphologiques liés à l'âge dans les mitochondries du cerveau et du foie. Ils ont conclu que le vieillissement des mitochondries peut être évité par des antioxydants et que « certains antioxydants sont également en mesure de prévenir l'altération des performances physiologiques, en particulier de la coordination motrice, qui survient avec le vieillissement ».
Succinate
Le succinate est un acide tricarboxylique du cycle intermédiaire de Krebs, qui donne des électrons directement au complexe II. Les succinates ont été largement utilisés, notamment en Russie, pour leur capacité à augmenter la performance sportive.
Un patient atteint d'insuffisance respiratoire et d'un défaut des complexes I, IV, V mitochondriaux a vu son problème complètement résolu par une posologie de 300 mg par jour de CoQ10 et de 6 g de sodium succinate17. Un autre patient avec une encéphalomyopathie mitochondriale a été amélioré de manière spectaculaire par un traitement avec 6 g de sodium succinate18.
Conclusion Le dysfonctionnement mitochondrial a été identifié comme l'une des principales causes du déclin bioénergétique lié à l'âge. Bien qu'il n'existe pas un produit « miracle » ni même une combinaison de substances capables de faire disparaître tous les aspects du vieillissement de la mitochondrie, les médecins et les scientifiques ont découvert qu'un certain nombre de nutriments et de substances permettent la restauration complète de nombreux aspects du fonctionnement de nos mitochondries. Les combinaisons de ces éléments nutritifs, agissant sur de multiples cibles, vont normaliser la fonction mitochondriale, augmenter le fonctionnement cellulaire et ainsi permettent une meilleure production d'énergie. De cette manière, les maladies liées à des déficits mitochondriaux vont être réduites et le déclin de nombreux organes du corps évité.
Le dysfonctionnement mitochondrial a été identifié comme l'une des principales causes du déclin bioénergétique lié à l'âge. Bien qu'il n'existe pas un produit « miracle » ni même une combinaison de substances capables de faire disparaître tous les aspects du vieillissement de la mitochondrie, les médecins et les scientifiques ont découvert qu'un certain nombre de nutriments et de substances permettent la restauration complète de nombreux aspects du fonctionnement de nos mitochondries. Les combinaisons de ces éléments nutritifs, agissant sur de multiples cibles, vont normaliser la fonction mitochondriale, augmenter le fonctionnement cellulaire et ainsi permettent une meilleure production d'énergie. De cette manière, les maladies liées à des déficits mitochondriaux vont être réduites et le déclin de nombreux organes du corps évité.
------------------------------------------------------------------------------------
Références :
1. Cohen B., Gold D., Mitochondrial cytopathy in adults: What we know so far, Cleveland Clinic. J. Medicine, 2001, 68:7,625-642.
2. South J., Idebenone: The Ultimate Anti-Aging Supplement?, Vitamin Research News, April 2001.
3. Sugrue M., Tatton W., Mitochondrial membrane potential in aging cells, Biol. Signals Recept., 2001, 10:3-4,176-188.
4. Opalka J., Gellerich F., Zierz S., Age and sex dependency of carnitine concentrations in human serum and skeletal muscle, Clinical Chemistry, 2001, 47:12,2150-2153.
5. Hagen T., Wehr C., Ames B., Mitochondrial decay in aging - Reversal through supplementation of Acetyl-L-Carnitine and N-tert-Butyl-alpha-phenyl-nitrone, Annals NY Acad. Sci., vol. 854, Towards Prolongation of the Healthy Life Span - Practical Approaches to Intervention, 1998, 214-223.
6. Chakraborti S., Batabyal S., Ghosh S., Chakraborti T., Protective role of N-acetylcysteine against the age-related decline in oxidative phosphorylation in pulmonary smooth muscle mitochondria, Med. Sci. Res., 1999, 27:(1),39-40.
7. Martin D., Towey M., Horrobin D., Lynch M., A diet enriched in alpha lipoic acid reverses the age-related compromise in antioxidant defenses in rat cortical tissue, Nutr. Neurosci., 2000, 3:3,193-206.
8. Hagen, Ingersoll R., Lykkesfeldt J. et al., R-alpha lipoic acid-supplemented old rats have improved mitochondrial function, decreased oxidative damage, and increased metabolic rate, FASEB J., 1999, 13:411-418.
9. Hansford R., Naotaka T., Pepe S., Mitochondria in heart ischemia and aging, Biochem Soc. Symp., 1999, 66:141-147.
10. Pepe S., Mitochondrial Function in ischemia and reperfusion of the ageing heart, Clin. Exp. Pharmacol. Physiol., 2000, 27(9),745-750.
11. Driver C., Georgiou A., How to re-energize old mitochondria without shooting yourself in the foot, Biogerontology, 2002, 3:103-106.
12. Lou H.C., Correction of increased plasma pyruvate and lactate levels using large doses of thiamine in patients with Kearns-Sayre Syndrome, Arch. Neurol., 1981, 38,469.
13. Arts W., Scholte H., Bogaard J. et al., NADH-CoQ reductase deficient myopathy: Successful treatment with riboflavin, The Lancet, 1983, 2:581-82.
14. Mittendorfer B., Klein S., Effect of aging on glucose and lipid metabolism during endurance exercise, Int. J. Sport Nutr. Ex. Metab., 2001, 11 (Suppl), S86-S91.
15. Lu J., Chen C., Xu H. et al., Effects of prolonged physical training on antioxidation in aged mice myocardial mitochondria, Tianjin Tiyu Xueyuan Xuebao, 1999, 14 (2), 23-25.
16. Sastre J., Pallardo F., De la Asuncion J., Vina J., Mitochondria, oxidative stress and aging, Free Radical Res., 2000, 32:(3),189-198.
17. Shoffner J., Lott, Voljavec A. et al., Spontaneous Kearns-Sayre/chronic external ophthalmoplegia plus syndrome associated with a mitochondrial DNA deletion: a slip-replication model and metabolic therapy, Proc. Natl. Acad. Sci. USA, 1989, 86:7952-56.
18. Kobayashi M., Morishita H., Okajima K. et al., Successful treatment with succinate supplement in a patient with a deficiency of Complex I (NADH-CoQ reductase), Int. Cong. Inborn Errors Metab. 4th, Sendai, Japan, 1987, p. 148.
Reservados todos os direitos de reprodução
Gratuito
Obrigado pela sua visita; antes de partir
INSCREVA-SE NOClub SuperSmart
de vantagens exclusivas:
- Gratuito: a publicação científica semanal "Nutranews"
- Promoções exclusivas para membros do clube